[메가경제=주영래 기자] 삼성바이오에피스와 오가논(Organon)은 미국 식품의약국(FDA)에 지난 8월 제출한 휴미라 바이오시밀러 '하드리마(HADLIMA™, 성분명 아달리무맙)'의 상호교환성(Interchangeability) 인증 관련 바이오의약품 변경 허가 신청서(sBLA: Supplemental Biologic License Application)에 대한 사전 검토가 완료돼(accepted for review) 본격 심사 절차에 돌입했다고 밝혔다.
삼성바이오에피스가 제출한 변경 허가 신청서는 오리지널 의약품과 고농도 제형 하드리마 간 약동학적 유사성을 확인하기 위해 중증도 내지 중증 판상 건선 환자를 대상으로 실시한 후속 임상(4상) 결과를 기반으로 하고 있다.
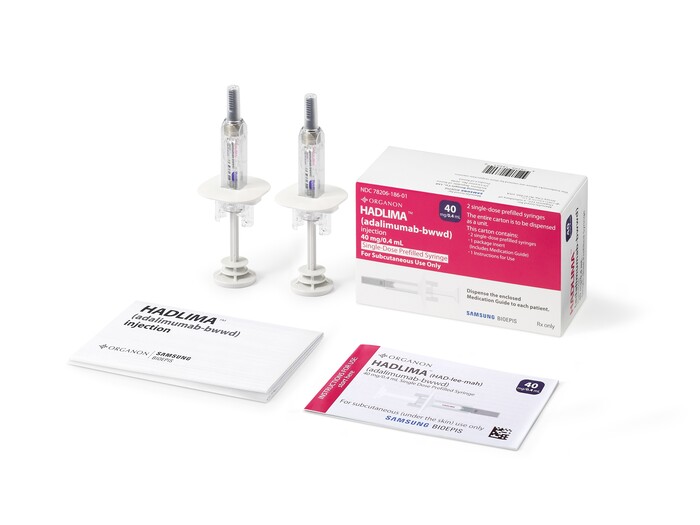 |
| ▲삼성바이오에피스, 휴미라 시밀러 '하드리마' 미국 상호교환성 허가 절차 돌입 |
정병인 삼성바이오에피스 RA(Regulatory Affairs) 상무는 “미국 내 환자들에게 당사 제품의 접근성을 확대하기 위해 하드리마 상호교환성 인증 허가를 신청했으며, 앞으로도 보건의료 산업의 지속가능성에 기여할 수 있는 바이오시밀러의 가치 실현을 위해 지속 노력해 나갈 것이다”고 전했다.
오가논 존 마틴(Jon Martin) 미국 바이오시밀러 사업 총괄(Head of US Biosimilars)은“상호교환성 허가는 약국 대체조제를 가능하게 하는 것 이상으로 바이오시밀러 처방에 대한 의료진의 신뢰도를 제고할 수 있다는 점에 의의가 있으며, 당사는 바이오시밀러를 통해 보다 합리적인 가격으로 더 많은 환자들이 치료받을 수 있는 기회를 제공해 나가겠다”고 전했다.
하드리마는 사전 충전형(prefilled) 주사기 및 자가 주사 제형의 오토인젝터(autoinjector: 자동 주사기)로 구성돼 있으며, 2019년 7월과 2022년 8월 각각 저농도(50mg/mL) 및 고농도(100mg/mL) 제제로 미국 품목 허가를 획득했고 2023년 7월 1일에 미국 시장에 출시돼 오가논에 의해 판매 중이다.
[저작권자ⓒ 메가경제. 무단전재-재배포 금지]