[메가경제=주영래 기자] 한미약품이 악성 피부암인 흑색종을 대상으로 개발 중인 표적 항암신약 ‘벨바라페닙’의 국내 임상 2상에 돌입했다. NRAS 유전자 변이 환자에 적절한 치료제가 없는 상황에서 국산 혁신 신약 개발 기대감이 커지고 있다.
한미사이언스 핵심 계열사인 한미약품은 식품의약품안전처로부터 벨바라페닙 임상 2상 시험계획서(IND)를 승인받았다고 8일 밝혔다.
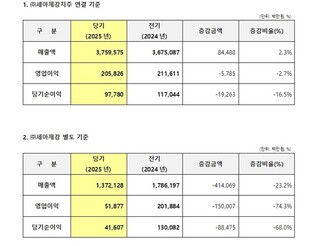
 |
| ▲ 한미 ‘벨바라페닙’ 국내 임상 2상에 돌입했다. |
이번 임상 2상은 NRAS 돌연변이를 보유한 국소 진행성 또는 전이성 흑색종 환자를 대상으로 벨바라페닙과 MEK 저해제 ‘코비메티닙’의 병용요법을 평가하는 다기관, 단일군 시험으로 진행된다. 흑색종은 재발률이 높고 치료 옵션이 제한적인 난치암으로 현재 국내 사용 약제 상당수가 해외 제품에 의존하고 있어 치료 접근성 문제가 꾸준히 제기돼 왔다.
벨바라페닙은 한미약품이 자체 개발한 경구용 표적 항암제로, 종양 성장에 관여하는 MAPK 신호전달 경로 중 RAF 및 RAS 변이를 선택적으로 억제한다.
특히 벨바라페닙은 RAF 이합체(dimer) 저해 기전을 기반으로 BRAF Class Ⅱ/Ⅲ 및 RAS 변이를 보유한 종양을 겨냥한다. 기존 BRAF 저해제가 단일체(monomer)를 중심으로 차단하는 것과 달리, 벨바라페닙은 BRAF·CRAF 이합체까지 표적함으로써 내성 문제를 극복하도록 설계된 것이 차별점이다.
이에 따라 벨바라페닙·코비메티닙 병용요법은 기존 BRAF 단일체 표적 치료의 기전적 한계를 보완하고, 변이 폭이 넓은 환자군에서 임상적 이점을 제공할 수 있을 것으로 기대된다.
임상 1상에서 두 약물 병용 투여 시 초기 항종양 효과와 안전성이 확인됐으며, NRAS·BRAF 변이를 가진 환자에서 유의미한 반응이 보고돼 후속 개발의 근거가 확보됐다.
벨바라페닙은 식약처가 지난해 도입한 혁신제품 제품화지원 프로그램 ‘길잡이’ 대상으로 선정된 바 있다. 해당 제도는 사회적 시급성과 상용화 가능성을兼한 혁신 의약품에 대해 개발 초기부터 허가 단계까지 맞춤형 자문 및 신속심사를 연계 지원하는 체계다.
식약처는 벨바라페닙 개발 과정에서 임상 설계·통계 검증·자료 구성 등을 다각적으로 지원하고 있으며, 향후 신속심사 제도(GIFT) 적용도 가능하다는 평가가 나온다.
현재 의료 현장에서는 치료목적사용 승인을 통해 일부 환자에게 제한적 투약이 이뤄지고 있다. NRAS 변이 흑색종은 국내외 치료제가 부재해 미충족 의료수요가 높은 영역으로 꼽힌다.
[저작권자ⓒ 메가경제. 무단전재-재배포 금지]